Zwei Fälle in GB
Corona-Impfung: Warnung vor allergischer Reaktion
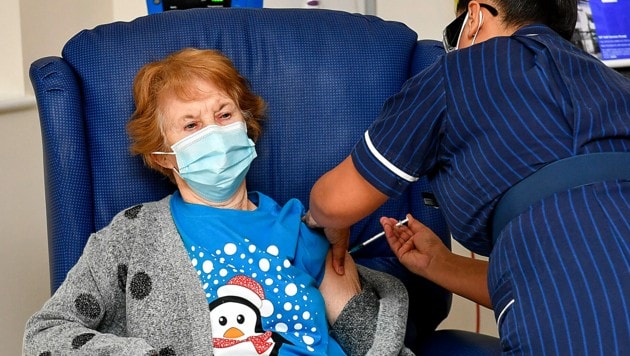
Kurz nach Beginn der Impfkampagne in Großbritannien hat die britische Arzneimittelaufsicht mit Nachdruck dazu geraten, vorerst niemandem mit einer „signifikanten“ Allergiegeschichte den Biontech-Pfizer-Impfstoff zu spritzen. Zwei Mitarbeiter des staatlichen Gesundheitsdienstes NHS mit einer entsprechenden Vorgeschichte hätten nach ihrer Impfung am Dienstag schwere allergische Reaktionen gezeigt und behandelt werden müssen, sagte NHS-Chef Stephen Powis am Mittwoch. „Beide erholen sich gut.“
Nach seinen Angaben sind die beiden Betroffenen so anfällig für Allergien, dass sie stets ein Notfallset mit Adrenalin bei sich tragen. Deshalb rate die britische Arzneimittelbehörde MHRA nun, „niemanden zu impfen, der in der Vergangenheit signifikante allergische Reaktionen auf Impfstoffe, Arzneimittel oder Lebensmittel“ hatte. Bei der Warnung handle es sich um eine reine Vorsichtsmaßnahme, fügte Powis hinzu.
Die MHRA hatte als weltweit erste Regulierungsbehörde dem Impfstoff vor einer Woche eine Notfallgenehmigung erteilt. Als erstes westliches Land wurde dann am Dienstag eine groß angelegte Impfkampagne gestartet. Zunächst erhalten Menschen aus der Hochrisikogruppe der über 80-Jährigen, Mitarbeiter in Pflegeheimen sowie besonders gefährdetes medizinisches Personal das Mittel des deutschen Unternehmens Biontech und seines US-Partners Pfizer.
Zweite Dosis bei Komplikationen nicht verabreichen
In der ersten Zeit stehen 800.000 Dosen zur Verfügung, vereinbart wurde eine Lieferung von insgesamt 40 Millionen Dosen. Für einen Immunschutz sind zwei Dosen notwendig. Die zweite Dosis sollte niemandem verabreicht werden, bei dem nach Verabreichung der ersten Dosis dieses Impfstoffs eine Anaphylaxie aufgetreten ist", sagte June Raine, MHRA-Geschäftsführerin in der Nacht auf Donnerstag.
Keine Probanden mit Allergie-Vorgeschichte zugelassen
Der Konzern erklärte nun, die MHRA habe ihn über die allergischen Reaktionen unterrichtet. Er bekräftigte aber gleichzeitig, dass der Impfstoff während der letzten klinischen Studie mit mehr als 40.000 Probanden „im Allgemeinen“ gut vertragen worden sei. Laut dem von Pfizer veröffentlichten Studienprotokoll wurden in der zulassungsrelevanten Untersuchung aber keine Teilnehmer aufgenommen, die eine Vorgeschichte schwerer allergischer Reaktionen auf einen Inhaltsstoff der Studie haben.
Behörden in USA und Europa prüfen noch
Die zuständigen Behörden in den USA und Europa, die FDA und die EMA, prüfen gegenwärtig noch eine Zulassung des Mittels von Biontech und Pfizer. In Kanada wurde die Arznei bereits genehmigt. Am Donnerstag soll sich der Beratungsausschuss für Impfstoffe der FDA zur Überprüfung der Daten der beiden Pharmaunternehmen treffen und eine Empfehlung abgeben. In einem am Dienstag veröffentlichten Dokument hatte die US-Arzneimittelbehörde bereits erklärt, keine Bedenken gegen den Einsatz des Vakzins zu haben. Bei Untersuchungen hätten sich keine neuen Probleme hinsichtlich seiner Sicherheit und Wirksamkeit ergeben. Die EMA will über das Vakzin von Biontech und Pfizer bis spätestens 29. Dezember, über das des US-Konzerns Moderna bis 12. Jänner entscheiden.






Kommentare
Da dieser Artikel älter als 18 Monate ist, ist zum jetzigen Zeitpunkt kein Kommentieren mehr möglich.
Wir laden Sie ein, bei einer aktuelleren themenrelevanten Story mitzudiskutieren: Themenübersicht.
Bei Fragen können Sie sich gern an das Community-Team per Mail an forum@krone.at wenden.